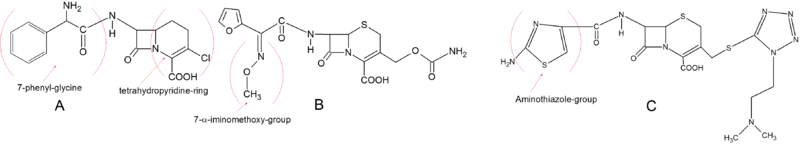Sefalosporinlerin keşfi ve gelişimi - Discovery and development of cephalosporins
Sefalosporinler , β-laktam halkasını içeren ve diğer β-laktam antibiyotiklerle (örneğin penisilinler , karbapenemler ve monobaktamlar ) yapısal benzerlik ve etki mekanizmasını paylaşan geniş bir bakterisidal antibiyotik sınıfıdır . Sefalosporinler (ve diğer β-laktamlar), bakteri hücre duvarı sentezindeki temel adımları engelleyerek bakterileri öldürme yeteneğine sahiptir ve bu da sonunda ozmotik liziz ve bakteri hücresinin ölümü ile sonuçlanır. Sefalosporinler, klinik etkinlikleri ve istenen güvenlik profilleri nedeniyle yaygın olarak kullanılan antibiyotiklerdir.
Sefalosporinler antibakteriyel spektrumları , suda çözünürlükleri , asit toleransları, oral biyoyararlanımları , biyolojik yarı ömürleri ve diğer özellikleri bakımından çeşitlilik gösterir . Bu nedenle, sefalosporinler antibakteriyel aktiviteye, buluşun zamanına ve yapısal temele bağlı olarak nesiller halinde daha fazla sınıflandırılabilir .
Sefalosporinlerin temel yapısı
Temel sefalosporin molekülünün çekirdeği, dihidrotiazin halkasıyla yoğunlaştırılmış bir β-laktam halkası içeren iki halkalı bir sistemden oluşur. Çekirdeğin kendisi , doğal bileşik sefalosporin C'den hidroliz yoluyla türetilebilen 7-aminosefalosporanik asit olarak da adlandırılabilir . Bu çekirdeği içeren kimyasal bileşikler, asit hidrolizi için nispeten kararlı ve β-laktamazlara toleranslıdır . Sefalosporin C, D-aminoadipik asitten türetilen bir yan zincir içerir. Yan zincirlerin ilgili pozisyonlarda modifikasyonu, tamamen yeni bir sefalosporin antibiyotik sınıfı oluşturmak için kullanılmıştır. Laktam halkasının 7. pozisyonundaki yan zincirlerin modifikasyonu antibakteriyel aktiviteyi etkilerken, dihidrotiazin halkasının 3. pozisyonu farmakokinetik özellikleri ve reseptör bağlanma afinitesini değiştirir.
keşif
Sefalosporin grubunun ilk kimyasal bileşikleri, ilk kez 1948'de Giuseppe Brotzu tarafından Sardinya kıyılarındaki bir kanalizasyon deşarjından keşfedilen sefalosporin üreten bir mantar olan Cephalosporium acremonium'dan izole edildi . Bilim adamları Cephalosporium acremonium kültürünün ham filtratlarından yeni antibakteriyel aktivite elde ettiler . Ham filtratın Staphylococcus aureus'un büyümesini engelleyebileceği kaydedildi .
Soruşturma
Sir Edward Abraham ve Guy Newton tarafından İngiltere'de daha ileri araştırmalar yapıldı ve Sardunya mantarından kültür sıvılarının izolasyonu sefalosporin P, N ve C'yi verdi. Bu doğal bileşiklerin antimikrobiyal ajanlar olarak kullanılabilecek kadar güçlü olduğu bulunmadı, ancak kimyasal yöntemlerle ve doğal yan zincirin çıkarılması, doğal olmayan yan zincirlerle daha da uyumlu olabilen 7-aminosefalosporanik asit ( 7-ACA ) üretmek mümkün oldu . 7-ACA, birkaç penisilin türevi yapmak için bir başlangıç bloğu olan 6-aminopenisilanik aside ( 6-APA ) benzerdir .
1959'da Abraham, sefalosporin C'nin N-fenilasetil türevinin , ana bileşiğe kıyasla Staphylococcus aureus suşlarına karşı çok daha güçlü olduğunu bildirdi . Bu türev daha sonra benzilpenisilin'in bir sefalosporin analoğu olan Cephaloram olarak adlandırıldı .
Eli Lilly , sefalosporin C'nin a-aminoadipoil yan zincirinin parçalanmasına dayanan 7-ACA üretmek için bir yöntem geliştirdi. Robert Morin tarafından yapılan daha fazla çalışma , penisilinlerden 3-deasetoksi-7-ACA'nın (7-ADCA) yarı sentezine yol açtı ; penisilinler, sefalosporinlerden daha kolay fermente edilebilirler . Örneğin, 7-ADCA, fenoksimetilpenisilin'den yedi kimyasal reaksiyon adımında yarı sentezlenebilir .
Sonuçlar
Parenteral kullanım için birinci nesil bir sefalosporin olan Sefalotin , 1964'te ABD'de hastalar için kullanıma sunulan ilk sefalosporindi . Eli Lilly'de hazırlanan 7-ACA türevleri serisinden klinik denemeler için seçildi . Parenteral kullanım için ikinci sefalosporin kısa bir süre sonra piyasaya çıktı ve ABD'de Cephaloridine adı altında pazarlandı . Bu iki sefalosporinin klinik başarıları, araştırmacıları farmakolojik özellikleri iyileştirmeye ve daha fazla ajan geliştirmeye teşvik etti. Bugün elimizde, bu iki başlangıç materyalinin kimyası üzerine yoğun araştırmalardan elde edilen bilgilere dayalı olarak binlerce yarı sentezlenmiş doğal sefalosporin bileşikleri analogları kaldı.
Hareket mekanizması
β-laktam antibiyotiklerin bakterisidal etkileri, bakteri hücre duvarı sentezinin inhibisyonu yoluyla elde edilir. Hücre duvarı hem de gram-pozitif ve gram-negatif bakterilere, bir sıkı , kovalent olarak bağlanmış ve çapraz bağlı peptidoglikan ağ ve için gerekli bakteriyel büyüme , hücre bölünmesi ve hücre yapısı. Bu nedenle bakteriler, bakteri büyümesi ve hücre bölünmesi sırasında hücre duvarını parçalayabilen enzimlere ihtiyaç duyarlar . Bakterilerin hücre duvarı, hücrenin dışından iki adımda oluşturulur. İlk adımda, uçlarında peptitlerle bağlı disakkarit birimlerinin molekülleri , bakteri sitoplazmasından taşınır ve bir transglikolaz ile duvarın dışında birleştirilir . İkinci adımda, bir transpeptidaz , peptit bağları yoluyla birbirine bağlanan uzun polisakarit zincirlerini birbirine bağlar . Amino asit D-alanil-D-alanin dizi peptid zincirinin sonunda transpeptidaz tarafından kabul edilmektedir. Enzim terminal ucundaki alanini ayırır ve kalanını bitişik bir polisakaritten bir peptit zincirine bağlar. Bu transpeptidasyon reaksiyonu, sefalosporinler gibi β-laktam antibiyotikler tarafından inhibe edilir. Bu inhibisyon nedeniyle, antibiyotikler en çok bakteriler büyümenin logaritmik fazındayken, o zaman hücre duvarını sentezlediklerinde etkilidir. Bakteriler büyümenin durağan fazındaysa, devam eden duvar sentezi yoktur ve antibiyotiklerin etkisi çok daha düşüktür.
β-laktam antibiyotiklerin etki mekanizması tam olarak bilinmemekle birlikte, etki mekanizmalarını, transpeptidaz D-alanil-D-alanin dizisine bağlandığında kimyasal reaksiyonun geçiş durumunun yapısını taklit ederek sergilediklerine inanılmaktadır. . Bu proteinler genellikle penisilin bağlayıcı proteinler (PBP) olarak adlandırılır. β-laktam halkasının enzim bağlanma bölgesindeki bir serin kalıntısı tarafından açılması, antibiyotik molekülünün enzimin aktif bölgesi ile kovalent bağlanmasına yol açar . Sonuç, daha fazla hücre duvarı sentezi yapamayan ve hücre ozmotik lizizden ölecek olan, aktif olmayan, geri dönüşümsüz olarak bağlı bir enzim kompleksidir.
İlaç tasarımı
Yapı aktivite ilişkisi
Sefalosporinin moleküler yapısı, in vitro stabiliteyi, antibakteriyel aktiviteyi ve β-laktamazlara karşı direnci geliştirmek için çeşitli şekillerde değiştirilebilir . Midenin asidik koşullarında , sefalosporin yapısının a1 ve a2 pozisyonlarına bir amino ve bir hidrojenin eklenmesiyle in vitro stabilite arttırılabilir . Bu , söz konusu koşullarda protonlanan bir amonyum iyonu olan bazik bir bileşik ile sonuçlanır ve bize oral olarak aktif bir ilaca yol açan daha kararlı bir β-laktam verir. A2 bir hidrojen yerine bir alkoksi grubu ise, anti-bakteriyel aktivite arttırılabilir . 7-amino grubu, antibakteriyel aktivite için çok önemlidir. Bazı durumlarda, A2 pozisyonuna bir metoksi grubu eklendiğinde , sefalosporin stabilitesi β-laktamazlara doğru arttırılır. A1 konumunda halkaya kükürt ve oksijen yerleştirilebilir. Sülfür daha iyi antibakteriyel aktivite gösterir, ancak oksijen β-laktamazlara karşı daha iyi stabilite gösterir. C6 konumunda, hidrojen biyolojik aktivite için çok önemlidir. A3 konumunda, A3 6 üyeli yerine 5 üyeli bir heterosikl olduğunda anti-bakteriyel aktivite daha fazladır . α1 ve α2 konumunda, L- izomeri β-laktamaza karşı D-izomerinden 30-40 kat daha kararlıdır. β-laktamaza karşı stabilite, metoksioksim ilavesiyle yaklaşık 100 kat arttırılabilir . Z-oksim, E-oksimden yaklaşık 20.000 kat daha stabildir.
bağlama sitesi
Rekombinant protein mühendisliği ve ekspresyonu, protein saflaştırma , NMR , X-ışını kristalografisi ve hesaplamalı kimya alanındaki gelişmeler , ilaç tasarımcılarının protein ligand komplekslerinin üç boyutlu yapıları üzerinde toplanan verileri kullanma becerilerini geliştirmiştir .
Çoğu bakteri türü, enzimatik fonksiyon, moleküler ağırlık ve β-laktam antibiyotiklere afinite gibi çeşitli şekillerde farklılık gösteren çeşitli PBP tiplerine sahiptir . β-laktamların bağlanma yeri açısından özellikle ilginç olan iki tip enzim vardır, PBP ve β-laktamazlar. PBP'nin bağlanma bölgesindeki hedef değişiklikleri, stafilokoklar , enterokoklar ve pnömokoklar gibi bakteriler arasında β-laktamların yüksek düzeyde direncine yol açmıştır . Örneğin, Neisseria gonorrhoeae'deki PBP2'nin bağlanma bölgesi yapısal olarak belirlenmiştir ve neredeyse tüm β-laktam etkileşimli enzimlerde görülebilen üç dizi motifine sahiptir.
- α2 sarmalının N-terminal ucunda yer alan ve enzim fonksiyonu için önemli olan iki kalıntı içeren SXXK motifi .
- Ser-310: Bir içermektedir serin nükleofil olan asile iki peptid ile alt-tabaka ve β-laktam antibiyotikler.
- Lys-313 : Aktif bölgede yoğun hidrojen bağlı ağın sağlanmasında önemli bir rol oynar ve Ser 310, ASN-364 ve Ser-362'nin karbonil omurgası mesafesinde bulunur .
- Ser-362, Ser-363 ve Asn-364'ü içeren SXN motifi
- Lys-497, Thr-498 ve Gly-499 içeren KTG motifi
Araştırma ayrıca, farklı PBP arasında farklılık gösteren aktif bölgeye bitişik bölgelerin, β-laktam asilasyon oranı üzerinde önemli bir etkiye sahip olduğunu ima eder.
Antimikrobiyal direnç
Sefalosporin bileşiklerine karşı bakteri direnci üç mekanizma ile gerçekleşebilir.
- Hedef PBP'deki değişiklikler
- Bakteriyel β-laktamazlarla ilaç inaktivasyonu
- İlaç bakteri hücresinde hedef PBP'ye ulaşamıyor
Sefalosporinler, hedef PBP'ye ulaşmak için bakteri hücre duvarından geçmelidir. Karşılaştırıldığında, gram pozitif bakterilerin hücre duvarına nüfuz etmek, gram negatif bakterilerin hücre duvarına girmekten daha kolaydır. Gram pozitif bakterilerin hücre duvarı yapısı rutin olarak sefalosporin boyutlu moleküllerin geçişine izin veren peptidoglikan tarafından yapılır. Gram negatif bakterilerin hücre duvarı yapısı polisakkaritler, lipidler ve proteinlerden oluşan daha karmaşıktır ve nüfuz etmesi daha zordur. Parçacıklar , trans membran proteinleri olan su dolu kanallar veya porinler yoluyla dış zardan geçer . Sefalosporinlere maruz kalma sırasında bakteri kendi başına veya mutasyon yoluyla çoğaldıktan sonra yeni nesil bakterilerin seçimi olarak direnç oluşturabilir . Pnömokok ve meningokok gibi bakteri türleri , ekzojen genetik materyal alabilir ve bunu kendi kromozomlarına dahil ederek antimikrobiyal dirence yol açabilir. Bu şekilde, hedef PBP, sefalosporinler ve diğer β-laktam antibiyotikler için çekiciliğini azaltacak şekilde değiştirilebilir. Bakteriler ayrıca Beta-laktam antibiyotiklere karşı savunmasız olan PBP'yi daha az savunmasız olan PBP ile değiştirebilir. β-laktam antibiyotikler, bakteriler tarafından üretilen birçok β-laktamaz türü tarafından inaktive edilebilir . Enzimler , β-laktam halkasının karbon ve nitrojen atomu arasındaki bağı hidrolize eder . Substrat özgüllüğü ve konak aralığı bakımından farklılık gösteren birçok beta laktamaz vardır. Enzimlerin aktif bölgesi hidrolitik olarak kolayca yenilenir, bu nedenle birçok kez yeniden kullanılabilir, bu şekilde nispeten az miktarda beta-laktamaz büyük miktarda ilacı yok edebilir. Stafilokoklar gibi gram-pozitif bakteriler, hücre dışı boşluklarına yüksek oranda beta-laktamaz salınımına sahiptir ve burada ilaçla hücre duvarının dışında buluşurlar. Gram negatif bakteriler ise daha konservatif bir seyir izlemektedir. Beta-laktamazlarını iç ve dış zar arasındaki periplazmik boşluğa salgılarlar, böylece hücre dışı boşluğa kolayca kaçamazlar ve yüksek miktarlarda biyosentezlenmeleri gerekmez.
İlaç geliştirme
Bu bölüm, nesiller arasındaki yapısal farklılıklara vurgu yaparak bir nesilden diğerine ilaç gelişimini gözden geçirecektir . Nesil sınıflandırma sistemi, sefalosporinleri kimyasal özelliklerine ve gram-negatif ve gram-pozitif bakterilere karşı nispi aktivitelerine göre ayırmaya dayanır. Birinci jenerasyon sefalosporinlerden üçüncü jenerasyona doğru, sırasıyla gram pozitif bakterilere karşı daha etkili olmaktan, gram negatif bakterilere karşı daha etkili ve gram pozitif bakterilere karşı daha az etkili olmaya doğru bir gelişme vardır. Ancak dördüncü nesilde aktivite gram negatif ve gram pozitif bakterilere karşı dengeli bir etkinliğe geri döner.
Sefalosporinlerin sınıflandırılması
Sefalosporin sınıfı çok geniştir, bu nedenle farklı sefalosporinleri birbirinden ayırt etmek için iyi bir sınıflandırma sistemi gereklidir. Sınıflandırma için kullanılabilecek birkaç kimyasal ve aktivite özelliği vardır, örneğin kimyasal yapı, yan zincir özellikleri, farmakokinetik, aktivite spektrumu veya klinik özellikler. Bu değişken özelliklere rağmen sefalosporinler için en yaygın sınıflandırma sistemi onları nesillere ayırmaktır. Üretim sistemi, farklı sefalosporinler tarafından gösterilen farklı antimikrobiyal aktiviteye dayanmaktadır.
1. nesil sefalosporinler
Birinci kuşak sefalosporinler, piyasadaki ilk sefalosporinlerdi. Gram pozitif bakterilere karşı iyi antimikrobiyal aktiviteye sahiptirler ancak gram negatif türlere karşı sınırlı aktiviteye sahiptirler. Birinci nesil sefalosporinlerin kimyasal yapıları oldukça basittir. Üç ilaçlar bu sınıftan bir örnek olarak ( Cephalexin , Sefradin ve Sefadroksil ) her pozisyon C-3 de tek bir metil grubuna sahiptir. Birinci sınıf sefalosporinler için C-3'teki ortak yan gruplar, metil gibi küçük yüksüz gruplardır. Metil grubu pozisyon C-3 azından kısmen, bu ilk ilaç nispeten düşük etkinliği açıklayabilir ortak PBP için düşük bir afiniteye verir. Bununla birlikte sefaklor , C-3 pozisyonunda PBP'ye daha iyi bağlanmasını ve dolayısıyla daha iyi antimikrobiyal aktivite sağlayan bir Cl grubuna sahiptir . C-3 pozisyonundaki Cl grubu ve dolayısıyla gelişmiş aktivitesi nedeniyle Sefaklor'un birinci kuşak sefalosporin olarak sınıflandırılması konusunda bir anlaşma yoktur, ancak daha çok C-7 yan zinciri nedeniyle böyle sınıflandırılır. birinci nesil, ikinci nesilden daha fazla. Birinci kuşak sefalosporinlerin tümü, C-7 konumunda bir a-amino grubuna sahiptir. Bu yapı onları β-laktamazlar tarafından hidrolize karşı savunmasız hale getirir.
2. nesil sefalosporinler
Erken ikinci kuşak sefalosporinler, temel yapı bakımından birinci kuşağa çok benzer. Ancak Lorakarbef , normal dihidrotiazin halkasına sahip değildir, ancak halkada bir kükürt atomu yerine bir karbon atomuna sahip olan bir karbasefam olup, onu bir tetrahidropiridin halkası yapar. Bu kimyasal özellik olarak Lorakarbef iyi bir stabilite kazandırmaktadır plazma PBP bağlanma için oral emilim özellikleri ve afinitesini muhafaza ederken. 7- fenil - glisin , oral olarak kullanılabilir hale getirir ve C-3 konumundaki klor, onu Sefaklor kadar aktif hale getirir. İkinci kuşak sefalosporinlerin gelişimindeki önemli bir yapısal değişiklik, bir a-imimetoksi grubunun C-7 yan zincirine katılmasıydı. Bu, beta-laktam halkasının stereokimyasal blokajı nedeniyle β-laktamazlara karşı artan bir direnç verdi. Sefuroksim , bu yan zinciri birleştiren ilk sefalosporindir. İkinci nesildeki bir diğer çok önemli grup , C-3 yan zincirinin aminotiyazol halkasıdır. Bu gelişme, PBP'ye bağlanma afinitesini büyük ölçüde arttırdı ve antimikrobiyal aktiviteyi arttırdı. Aminotiyazol halkası, Cefotiam'ın yapısında görülebilir .
3. nesil sefalosporinler
Üçüncü kuşak sefalosporinlerin çoğu, C-7 pozisyonunda aminotiyazol grubuna sahiptir. 7-α-iminohidroksi ve 7-α-iminometoksi gibi 7-α-pozisyonunda farklı gruplar bulunur. Ancak seftibuten bir 7-α-etiliden grubuna sahiptir. Bu grup, seftibuten'e gelişmiş spektrumlu β-laktamazlara karşı daha yüksek direnç verir. Oral üçüncü kuşak sefalosporinlerin çoğu , parenteral formların esterleridir ve sindirim sistemindeki esterazlar tarafından hidrolize edilir ( Cefteram -pivoxil). Üçüncü kuşak ilaçların bazıları, esterifikasyona gerek kalmadan oral yoldan absorbe edilebilir . Bu, örneğin Cefixime ve Cefdinir ile bir vinil grubu C-3 pozisyonuna yerleştirilerek yapılır.
4. nesil sefalosporinler
Dördüncü kuşak sefalosporinler, gram-negatif bakterilere karşı ikinci ve üçüncü kuşaktan daha fazla aktiviteye sahiptir. Bu fark, onların dipolar iyonik zwitterion bileşikleri olmalarına bağlanmaktadır . C-7 yan zinciri, genellikle iminometoksi-aminotiyazol grubu veya Sefklidin durumunda bir aminotiadiazol içeren üçüncü kuşak sefalosporinlere benzer . C-3 yan zincirindeki pozitif yüklü kuaterner nitrojen nedeniyle dördüncü kuşak sefalosporinler, gram-negatif bakteri zarından önceki sefalosporinlere göre daha kolay difüze olabilir. Pozitif yükün ilaç molekülünü porin kanalının girişine yönlendirdiği düşünülmektedir.
5. nesil sefalosporinler
Şu anda bu kategoride sadece iki ilaç var, Ceftobiprol ve Ceftarolin . Bu yeni ilaçlar aynı zamanda metisiline dirençli Staphylococcus-aureus'a (MRSA) karşı etkili olan tek β-laktam antibiyotiklerdir . Seftobiprol a, pirolidinon -3 ilidenmetil kefem. C-3 yan zinciri, PBP2a ve PBP2x'e güçlü bir bağlanma afinitesine sahip olacak şekilde özel olarak tasarlanmıştır. PBP2a'nın diğer β-laktam ilaçlara stafilokok direnci verdiği bilinmektedir ve PBPx aynı şeyi pnömokoklar için yapar . Seftobiprol ayrıca C-7 pozisyonunda S. aureus kaynaklı β-laktamaza iyi direnç verdiği bilinen bir aminotiazoilhidroksiimino yan zincirine sahiptir . Bu aktif gruplar birlikte Seftobiprol'ü MRSA'ya karşı bakterisit yapar. Seftobiprolün suda çözünürlüğü zayıftır ve bu nedenle Ceftobiprol medocaril adı verilen bir ester ön ilacı olarak intravenöz olarak uygulanır. Plazma esterazları tarafından hızla aktif Seftobiprol'e parçalanır. Seftarolin, dördüncü kuşak sefalosporin Cefozopran'dan geliştirildi . Alkoksiimino grubunu önceki nesillerden C-7 konumunda tutar, bu nedenle birçok β-laktamaz varlığında oldukça stabildir. MRSA ve penisiline dirençli Streptococcus pneumoniae , sırasıyla yeni PBP, PBP2a ve PBP2x türlerine yönelik dirence sahip olduğundan, hem Ceftarolin hem de Ceftobiprol, bu yeni PBP'yi bağlamak için özel olarak tasarlanmış C-3 yan zincirlerine sahiptir. Seftarolin durumunda bu yan zincir, anti-MRSA aktivitesi için optimize edilmiş bir 2-tioazolitiyo aralayıcı bağlantısı içerir. Seftarolin düşük suda çözünürlüğe sahiptir, ancak intravenöz ön ilaç Ceftarolin fosamili oluşturan moleküle bir N-fosfonoamino grubu eklenerek bu sorunun üstesinden gelinmiştir. Ön ilaç plazmada defosforile edilerek aktif Ceftarolin oluşturulur.
Şu anki durum
Antimikrobiyal direnç, yeni antimikrobiyal ajanların geliştirilmesi için itici güçtür. Direnç mekanizmalarının karmaşıklığı ve çeşitliliği, yeni ve geliştirilmiş β-laktam antibiyotiklere olan ihtiyacı tanımlamıştır. Geniş spektrumları ile sefalosporinler, sıklıkla oral biyoyararlanımdan yoksun olmalarına rağmen β-laktam kemoterapisine hakim olmuştur .
29 Ekim 2010'da yeni bir sefalosporin ajanı - Ceftarolin - gıda ve ilaç idaresi (FDA) tarafından onaylandı . Teflaro (seftarolin fosamil), akut bakteriyel cilt ve cilt yapısı enfeksiyonları (ABSSI) ve toplum kökenli bakteriyel pnömoni (CABP) olan yetişkinleri tedavi etmek için enjekte edilebilir bir antibiyotik ön ilacıdır.
Seftobiprol, 12 Avrupa ülkesinde, Kanada ve İsviçre'de hastane kaynaklı pnömonisi (VAP hariç) ve toplum kökenli pnömonisi olan yetişkin hastaların tedavisi için onaylanmıştır.